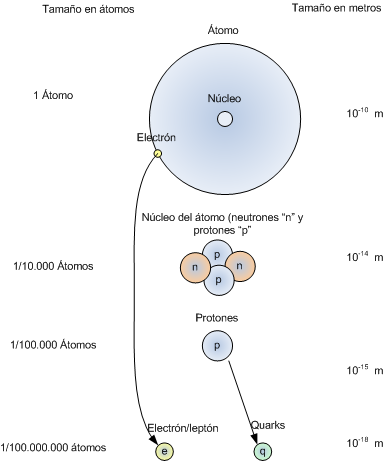
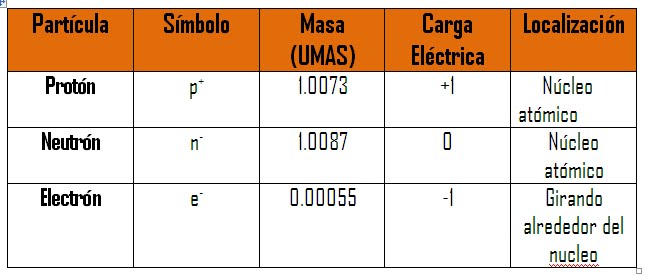
Configuración electrónica: distribución de los electrones en los diferentes orbitales en las capas principales y subcapas..
Reglas y Principios de la Configuración Electrónica de los átomos:
Principio de Exclusión de Pauli: dos electrones de un átomo no pueden tener los 4 números cuánticos iguales.
Número Cuántico Principal (n):
Puede tener valores enteros positivos de 1, 2, 3, etc. Al aumentar n, el orbital se hace más grande, y el electrón pasa más tiempo lejos del núcleo. Un aumento en n también implica que el electrón tiene mayor energía, y por tanto, está unido menos firmemente al núcleo. Por tanto, el valor de n define la energía de un orbital.
Todos los orbitales con el mismo valor de n se encuentran en la misma capa electrónica principal o nivel principal.
n = 1 → primera capa; n = 2 → segunda capa, …
Para calcular la cantidad de electrones de un nivel energético se utiliza la fórmula 2*n^2.
Número Cuántico azimutal o secundario (ℓ):
Número cuántico azimutal, o angular ℓ, define la forma del orbital. Todos los orbitales con el mismo valor de ℓ se encuentran en la misma subcapa o subnivel
Para cierto valor de n, ℓ tiene todos los valores enteros posibles desde 0 hasta (n – 1):
n = 1 → ℓ = n – 1 = 1 – 1 = 0.
n = 2→ ℓ puede tener dos valores: 0 y 1.
n = 3→ ℓ puede tener tres valores: 0, 1 y 2.
El valor de ℓ generalmente se designa con las letras s, p, d y f, que corresponden a valores de l de 0, 1, 2 y 3, respectivamente:
ℓ = 0 → orbital s
ℓ = 1 → orbital p
ℓ = 2 → orbital d
ℓ = 3 → orbital f
Para calcular la cantidad de electrones de un sub-nivel energético se utiliza la formula (2*ℓ+1)
Número Cuántico Magnético ( mℓ):
Puede tener valores enteros entre ℓ y - ℓ, lo que incluye cero. Este número cuántico describe la orientación del orbital en el espacio.
Dentro de un subnivel, el valor de mℓ depende del valor que tenga el número cuántico del momento angular, ℓ. Para cierto valor de ℓ existen (2ℓ + 1) valores enteros de mℓ.
Si ℓ = 0, entonces mℓ = 0. Si ℓ = 1, entonces existen [(2 × 1) + 1], o tres valores de mℓ: –1, 0 y 1. Si ℓ = 2, hay [(2 × 2) + 1], o cinco valores de mℓ : –2, –1, 0, 1 y 2.
Número Cuántico Espín del Electrón (ms):
Los experimentos realizados con los espectros de emisión de los átomos de sodio e hidrógeno indicaban que las líneas del espectro de emisión se podían separar aplicando un campo magnético externo. Los físicos sólo pudieron explicar estos resultados suponiendo que los electrones se comportan como pequeños imanes. Si nos imaginamos que los electrones giran sobre su propio eje, es factible explicar sus propiedades magnéticas.
Según la teoría electromagnética, cuando gira una carga se genera un campo magnético, y este movimiento es el responsable de que el electrón se comporte como un imán.
Para tomar en cuenta el espín del electrón es preciso añadir un cuarto número cuántico, conocido como número cuántico de espín del electrón (ms), que toma valores de +½ y - ½ .
Regla de Hund: cuando hay orbitales degenerados, los electrones ocupan en primer lugar estos orbitales de forma desapareada.
Como el caso del carbono explicado en el vídeo.
Principio de Aufbau: Los electrones entra siempre en los niveles más bajos de energía.
Aufbau (del alemán Aufbauprinzip: principio de construcción)
Regla de Madelung: Cuando dos orbitales tienen el mismo valor para n + ℓ, es más estable el de menor nivel energético n.
Para estas dos últimas reglas se utiliza el diagrama de Moeler
La aplicación del diagrama de Moeler tiene las siguientes excepciones:
Todas etas regles nos permite escribir correctamente la Configuración Electrónica que se lee:
Ejercicios Propuestos:
1. Haga un listado de los valores n, ℓ, mℓ, para los orbitales del subnivel 4d.
2. ¿Cuál es el número total de orbitales asociados al número cuántico principal n=3?
3. Escriba los cuatros números cuánticos para un electrón situado en un orbital 3p.
4. Escriba las configuraciones electrónicas del cloro, hierro, potasio, hidrógeno, nitrógeno, y azufre, dibuje sus casas cuánticas.
Ejercicios Propuestos:
1. Haga un listado de los valores n, ℓ, mℓ, para los orbitales del subnivel 4d.
2. ¿Cuál es el número total de orbitales asociados al número cuántico principal n=3?
3. Escriba los cuatros números cuánticos para un electrón situado en un orbital 3p.
4. Escriba las configuraciones electrónicas del cloro, hierro, potasio, hidrógeno, nitrógeno, y azufre, dibuje sus casas cuánticas.